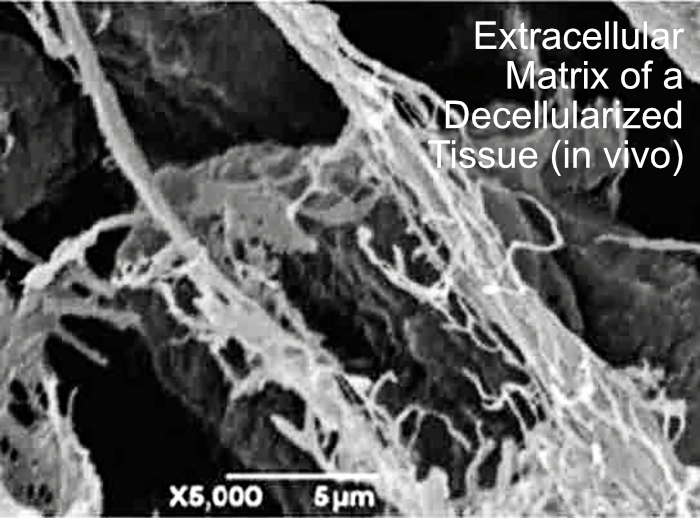
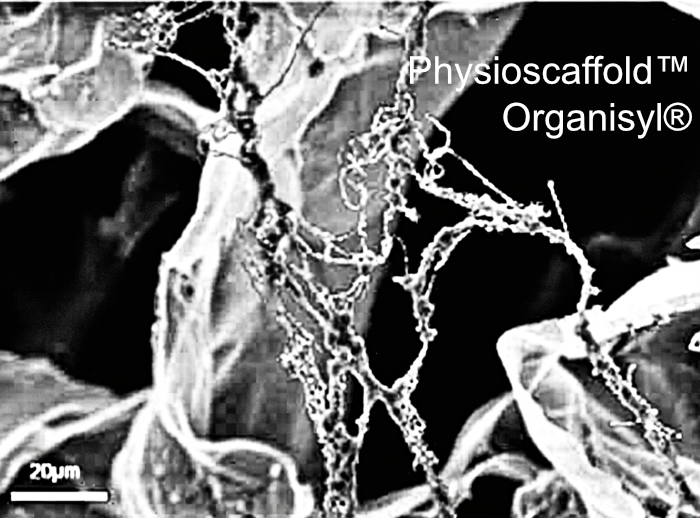
Qu’est-ce que la matrice extra-cellulaire :
La matrice extracellulaire joue un rôle essentiel dans la régulation du comportement des cellules qui interagissent avec elle, notamment en modulant le développement cellulaire, la migration cellulaire, la prolifération cellulaire, la différenciation cellulaire, l'adhésion cellulaire et l'architecture spatiale des cellules et des tissus (Hu et al., 2022).
La matrice extracellulaire est un réseau 3D viscoélastique de macromolécules sécrétées par les cellules mésenchymateuses résidentes (essentiellement des fibroblastes) et constituées de :
Éléments structuraux :
Les protéoglycanes (PG) composés d'une protéine principale et de glycoaminoglycanes (GAG), l'acide hyaluronique (AH) étant le principal GAG et le seul non sulfaté (Karamanos et al. 2018) et protéines structurales (collagènes, élastine, par exemple) créant un échafaudage solide qui maintient la structure du tissu.
Protéines d'adhésion :
Ces protéines (laminine et fibronectine, par exemple) permettant diverses interactions cellule-matrice spécifiques au type cellulaire.
La composition de la matrice extracellulaire (MEC) diffère également selon les tissus, tant au niveau de sa composition que de ses propriétés physiques.
De plus, les MEC peuvent être divisées en deux catégories comme le montre la figure ci-dessous :
Les matrices péricellulaires :
comme la membrane basale, sont situées à l'interface entre le tissu conjonctif et le parenchyme et sont en contact étroit avec les cellules épithéliales et endothéliales (Pozzi, Yurchenco, et Iozzo 2017).
La membrane basale est constituée de deux réseaux interconnectés de collagène de type IV et de laminines interagissant avec d'autres molécules telles que les nidogènes, les intégrines, le perlécane, l'aggrécane et les collagènes de types VII, XV et XVIII (LeBleu, Macdonald, et Kalluri 2007)
Les matrices interstitielles :
Elles sont principalement composées de GAG, dont l'acide hyaluronique (AH) est le principal, de différents types de collagènes, d'élastine, de fibronectine et d'autres protéines (Theocharis et al. 2016).
Au sein de cet assemblage appelé stroma, les cellules du tissu conjonctif, les nerfs et les vaisseaux sanguins et lymphatiques assurent la survie des cellules endothéliales et immunitaires, des fibroblastes, des adipocytes et des péricytes.
La matrice interstitielle fournit la structure du tissu, garantit son intégrité physique et mécanique, assure le maintien du pH et de l'hydratation, ainsi que la disponibilité des cytokines et des facteurs de croissance.
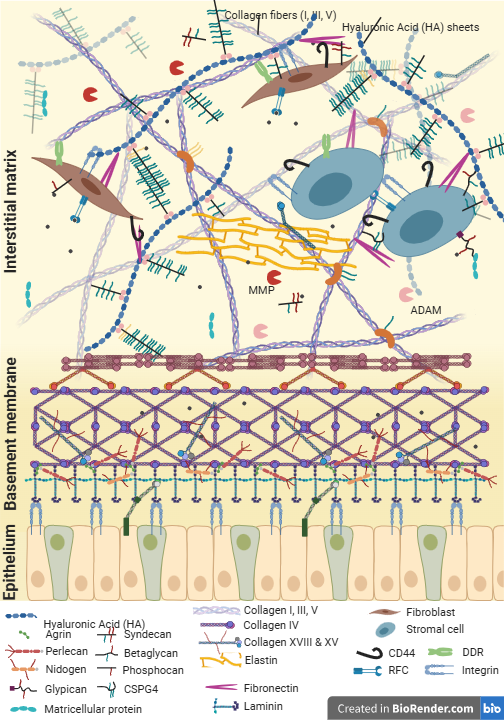
Le rôle de l'acide hyaluronique (AH)
L'AH est un composant essentiel de la matrice extracellulaire (MEC)
Il régule l'intégrité structurelle et le développement normaux, ainsi que les réponses tissulaires lors des lésions, de la réparation et de la régénération (Garantziotis et Savani, 2019).
L'AH est le seul membre des glycosaminoglycanes (GAG) à être un GAG non sulfaté, dépourvu de protéine majeure, avec une structure polysaccharidique linéaire composée d'acide D-glucuronique et de D-N-acétylglucosamine, liés entre eux par des liaisons glycosidiques (Theocharis et al., 2016). Il assure la résistance à la compression, la lubrification et l'hydratation de la MEC.
L'AH peut être présent libre, créant un environnement visqueux pour les cellules (Tamer 2013), ou lié aux PG, formant l'échafaudage solide qui maintient la structure du tissu.
L'AH possède des propriétés physicochimiques qui confèrent aux tissus une grande plasticité grâce à sa capacité de rétention d'eau (Dong et al. 2020). Celle-ci joue un rôle important lors du développement embryonnaire, au cours duquel les tissus se réorganisent (Garantziotis et Savani 2019).
De plus, l'AH peut interagir avec des récepteurs présents à la surface des cellules tels que CD44 (Bhattacharya et al. 2017) ou RHAMM (récepteur de motilité médié par l'acide hyaluronique HMMR) (Misra et al. 2015), afin de moduler certains processus tels que la transduction du signal et l'assemblage de la matrice péricellulaire. L'AH, par ses interactions avec ces récepteurs de la membrane cellulaire, participe à plusieurs interactions à la surface cellulaire et contribue ainsi de manière significative à la prolifération, à la migration et à la différenciation cellulaires.
Outre les GAG non sulfatés (HA), des GAG sulfatés (chondroïtine sulfate, dermatane sulfate, héparane sulfate, héparine, kératane sulfate) sont également présents dans la matrice extracellulaire couplés à des protéines, également appelées protéoglycanes (Iozzo et Schaefer 2015)
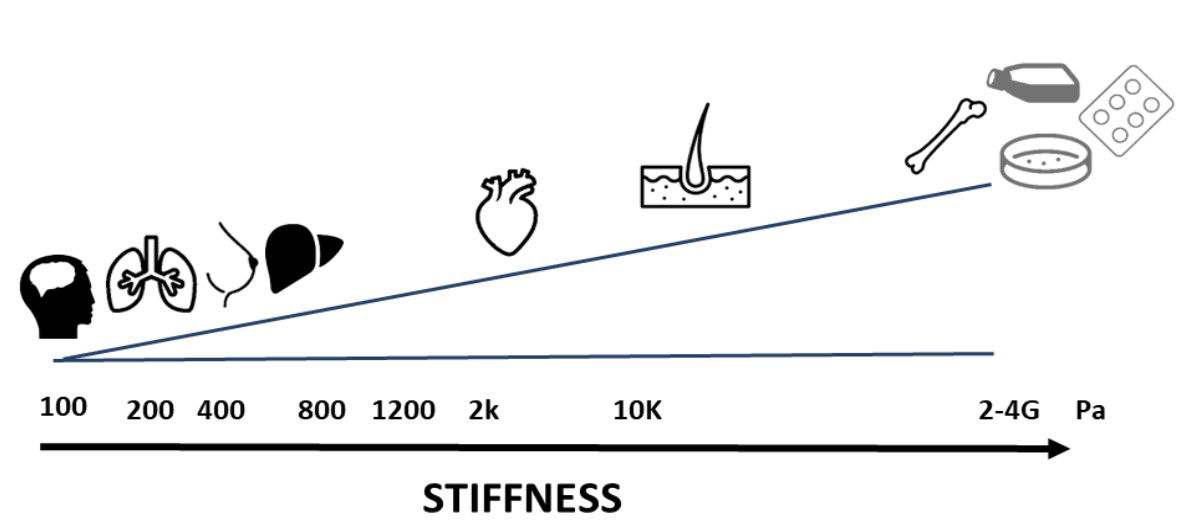
Les propriétés physiques des organes
Chaque organe possède ses propres propriétés physiques :
Elles ont notamment une rigidité spécifique, comme le montre la figure ci-dessous.
Le module d'élasticité varie de 0,1 kPa pour les tissus mous (ex. : cerveau) à au moins 100 kPa pour les tissus durs (ex. : peau) ou 20 GPa pour les os (Akhmanova et al. 2015).
La rigidité et l'élasticité de la MEC ont des implications importantes sur la migration cellulaire, l'expression et la différenciation des gènes. La composition et l'élasticité d'un tissu sont également modifiées dans des conditions pathologiques, telles que le cancer ou la fibrose.
Il est important de noter que, lorsque l'on travaille sur du plastique – comme dans la plupart des modèles in vitro actuellement utilisés dans le processus de découverte de médicaments et dans les laboratoires universitaires – les propriétés physiques n'ont aucun sens :
le module d'élasticité est supérieur à celui de l'os (Figure ci-dessous).
les propriétés mécaniques diffèrent
Elle différent également selon l'organe.
Le tableau 2 présente les propriétés viscoélastiques, avec module de conservation (G′) et module de perte (G″), des différents organes humains.
Tous les échantillons présentent des valeurs de G’ (module de conservation) supérieures à G’’ (module de perte) sur toute la gamme de fréquences testée, ce qui indique la prévalence du comportement élastique sur le comportement visqueux de la matrice extracellulaire dans tous les organes/tissus.
| Organ/Tissue | G' (kPa) | G'' (kPa) |
|---|---|---|
| Brain | 0.1–1 | 0.05–0.3 |
| Lung | 0.3–3 | 0.1–0.7 |
| Liver | 0.5–5 | 0.1–1 |
| Kidney | 0.5–6 | 0.2–1.2 |
| Heart | 2–15 | 0.3–2 |
| Skin (Dermis) | 10–30 | 2–8 |
| Bone (non-mineralized) | 10–100 | 1–10 |
Les supports de culture 3D existant :
Il existe trois principales approches pour créer des systèmes de culture cellulaire 3D, avec des limitations:
les systèmes sans échafaudage :
Ils utilisent des plaques à goutte suspendue (Foty 2011) ou à faible adhérence (Kochanek, Close, et Johnston 2019) ; sans matrice;
les systèmes à base d'hydrogel :
Naturel ou synthétique, ils sont principalement avec les mêmes composants que ceux utilisés pour le coating des plaques :
-absence d'éléments solides très faible porosité
- viscosité élevée qui encapsule les cellules
- nutriments et échanges gazeux
- limités par la faible porosité (Figueiredo et al. 2018 ; Lu et al. 2024 ; Saghir, Imenes, et Schiavone 2023 ; Xie et al. 2022) ;
les échafaudages solides :
Ce sont des systèmes de type plastique fabriqués par procédé physique ou à base de fibres végétales :
- absence d'adhésion cellulaire spécifique
- inertie
- rigidité élevée
- absence d'élasticité
- amas cellulaires produits à l'intérieur des cavités des échafaudages solides (Alaribe, Manoto, et Motaung 2016; Echeverria Molina, Malollari, et Komvopoulos 2021; Moreno 2008).

La révolution Organisyl®
La technologie Organisyl :
Les biologistes ont constamment besoin de maintenir les cellules vivantes et fonctionnelles tout au long du processus de culture cellulaire. Aucun des supports de culture de cellules décrits ci-dessus ne recrée les caractéristiques physicochimique organe-spécifique de la MEC in situ.
Cependant, ce problème est maintenant résolu par la production de matrices spécifiques à chaque organe, des supports physiologiques brevetés, obtenus par le procédé Organisyl. Ces matrices comprennent deux processus consécutifs avant stérilisation :
- un premier procédé chimique pour créer un gel ou pseudo-gel visqueux comportant l’ensemble des constituants de la matrice extra-cellulaire d’un organe cible dans les mêmes proportions
- un second procédé physique de transformation de cet hydrogel en supports physiologiques, appelé physioscaffold™ de mêmes caractéristiques physiques et mécaniques que la MEC de l’organe cible: même rigidité, même porosité, même propriété viscoélastique à dominante élastique.
Les procédés chimiques et physiques de changement d’état sont développés sur mesure pour adapter la composition et les propriétés physiques et mécaniques des physioscaffolds™ en fonction de la MEC de l’organe cible, sain ou pathologique.
Les résultats :
Afin de recréer un organoïde in vitro à l'aide d'un Physioscaffold™ Organisyl®, les cellules sont ensemencées dans un petit volume (identique au volume d'hydrogel coulé) sur des Physioscaffolds lyophilisés.
Telle une éponge, les Physioscaffolds absorbent le milieu contenant les cellules grâce aux groupes fonctionnels hydrophiles de l'acide hyaluronique (liaison hydrogène avec l'eau).
Les cellules pénètrent dans le Physioscaffold™ et se fixent aux protéines d'adhésion greffées dans la matrice.
En testant différentes propriétés chimiques et physiques des supports physiologiques, les cellules ont montré des comportements totalement différents.
Ainsi, en développant des propriétés chimiques et physiques spécifiques selon l'organe cible, les cellules se développent dans un environnement adapté, restent vivantes et fonctionnelles bien plus longtemps.